【基因重组系统Cre工具鼠Flox小鼠条件性敲除动物模型】
Flox小鼠Cre工具鼠应用:
1、 Cre-lox系统通常包括两种小鼠: 一是 Cre工具鼠, 该小鼠中的Cre重组酶由特定启动
子驱动, 可在特定细胞或组织表达Cre重组酶; 二是Flox小鼠, 即在小鼠靶基因序列两侧
带有Lox位点。将上述两种小鼠杂交繁育,子代中可以获得既带有Cre又带有Flox基因的
小鼠,即基因条件性敲除或过表达小鼠。

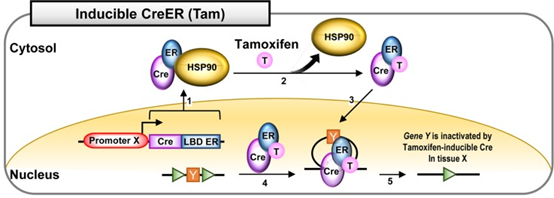
2.1 CreER 系统
也叫tamoxifen他莫昔芬诱导的Cre系统, 将Cre与雌激素受体ER 融合, 可通过他莫昔芬(tamoxifen)
诱导Cre的重组活性。 在没有他莫昔芬的情况下,CreER 融合蛋白与热休克蛋白90(HSP90)
相互作用并存在于细胞质中。 给予tamoxifen他莫昔芬药物处理会破坏 HSP90 与CreER的相互作用。ER
与他莫昔芬tamoxifen的相互作用诱导Cre的核易位。在细胞核中,CreER识别loxP位点并使组织X中的
基因Y失活。 CreERT2在体内对药物诱导的敏感性更高, 因此一般优选使用CreERT2。
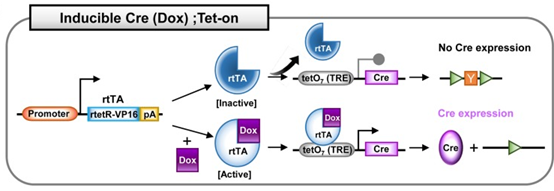
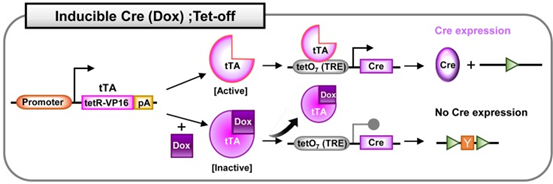
2.2 Cre;Tet 系统
四环素诱导系统,也叫强力霉素(Dox,四环素衍生物)诱导的Cre系统。 该系统有两种模
式:Tet-on和 Tet-off, 分别是Dox依赖性 Cre 的激活和Dox依赖性Cre的失活。 Tet 系统
包括以下元件:反向四环素控制反式激活因子(rtTA) ; 四环素控制反式激活因子(tTA) ;
四环素响应元件(TRE) ,通常是19 个核苷酸的四环素操纵子(tetO)序列的7个重复,调
节 Cre 基因的表达。 Dox 通常在小鼠的饲料或饮水中进行给药。
Flox鼠与Cre鼠的配繁
在实际应用中,通过不同的Flox鼠与Cre鼠的配繁可以实现多种研究目的,通过组织/细胞特异性Cre鼠敲除特定组织/细胞群体的特定基因是最为常见的一种。
F0代与野生鼠互配获得F1代杂合子,F1代杂合子(flox/+)互配得到F2代纯合子(flox/flox),F2代纯合子(flox/flox)与全身/组织特异性工具鼠交配获得F3代(flox/+, Cre),F3代(flox/+, Cre)互配得到F4代(flox/flox, Cre),即cKO/cKI纯合子。
设计要点
(1)如果是通过打靶构建的全身/组织特异性工具鼠,要注意选择与目的基因不在同一条染色体上,以免繁殖不到cKO/cKI纯合子。
(2)有生殖细胞泄露风险的Cre工具鼠,繁殖时按照建议性别选择不同基因型鼠。
(3)诱导型的Cre工具鼠,需要加药后才能实现特异组织删除。
(4)F1代若有剩余的flox杂合鼠(flox/+),或想要加快获得目标鼠,第2步可以用flox/+直接配Cre工具鼠,可缩短一代周期。
(5)即使是组织特异性工具鼠,也可能在其他组织有泄露表达的风险。
TCR转基因小鼠2.0
4、 SMARTA-1: B6.Cg-Ptprca Pepcb Tg(TcrLCMV)1Aox/PpmJ
SMARTA-1 TCR 转基因系 P13 针对 H2-I-A+b限制性 LCMV GP61-80 表位( 以及CD45.1等位基因。 这些小鼠可用于研究CD4活化和分化的细胞机制, 并作为供体细胞的来源, 用于炎症,耐受性和抗病毒反应的体内研究。
5、 TEa: B6.Cg-Tg(Tcra,Tcrb)3Ayr/J
TEa Tg 小鼠表达含有重排 T 细胞受体的转基因, 该受体可识别 H2-Ea(Ealpha52-68) /H2-Ab(IAb)复合物。流式细胞术分析显示, 90%和95%的CD4+脾脏细胞分别表达Tcra-V2和 Tcrb-V6,这些转基因半合子的小鼠是可行的, 可育的和正常的大小。 这种突变小鼠可用于阳/阴性选择、 T 细胞受体相互作用或移植物抗宿主病的研究。
6、 B6 Thy1.1/Cl.1 TCR: B6.PL-Thy1a/CyJ
携带 T 淋巴细胞特异性 Thy1a( Thy1.1) 等位基因。 通过使用适当的抗体进行流式细胞术和组织学分析, 可以很容易地将供体 T 细胞与受体 T 细胞区分开来。 Thy1.1 的表达于 2022年使用流式细胞术和 OX7 单克隆抗体得到证实。
7、 2C TCR: B6-Tg(Tcra2C,Tcrb2C)1Dlo
用于研究 TCR 与肽/主要相容性复合物结合的分子基础以及细胞毒性 T 淋巴细胞( CTL) 的细胞毒性机制。
工具鼠之45.1 与 45.2
表达 CD45.1 的小鼠品系包括 FVB、 RIII、 SJL/J、 STS/A、 DA 等, 表达 CD45.2 的小鼠品系包括 AKR、 BALB/c、 CBA/Ca、 CBA/J、 C3H/He、 C57BL、 C57BR、 C57L、 C58、 DBA/1、 DBA/2、 NZB、SWR、 129 等。 实验研究中可采用 CD45.1 和 CD45.2 做供受体之间的细胞过继转移, 从而研究细胞的增殖分化分布等特征。
关于K14-CreERT小鼠他莫昔芬诱导后小鼠体内所有上皮的靶基因就完全消失了么,有没有可能随着时间增加新生上皮依旧会表达靶基因??
1、诱导后有一定脱靶的可能性,需要鉴定;
2、他莫昔芬作用时间有限,这种诱导方式常用于时间动态性研究;
3、可以看一下这篇文献对于他莫昔芬诱导的使用,Regulatory T cells function in established systemic inflammation and reverse fatal autoimmunity;
4、可以看一下南模生物关于诱导性敲除的解释,如何构建如何作用,有助于更好地理解
cre的那个基因,是不是要选择与flox中间基因能结合的蛋白?cre一般用于特异性细胞选定,比如T细胞是CD4cre,巨噬细胞是lyzcre
flox/flox和-/-是同一个意思吗?
敲除可以都可以用-/-,这是一种表述方式,根据描述判断是何种敲除,flox/flox是构造敲除的一种方式,常与cre联用意味着条件性敲除;
cre-er基因必须是杂合么?纯合可不可以?cre-er基因杂合纯合都可以,看纯合子致不致死,不致死的话理论上都行,
cre阳flox杂合可以互相交配吗?还是必须跟flox纯交配?一般构建流程是先flox杂,第二代生出flox纯再与cre交,得到cre杂flox杂,再交出第四代带cre的flox纯合子

1987年Brian Sauer博士报道了Cre-loxP重组系统可用在细胞中操作特定位点的特异性重组,由于该系统具有操作简单、重组率高的优点,如今已成为体内外遗传操作的常用工具。现在利用Cre-lox系统,我们可以在特定细胞、组织或整个生物体,甚至在特定时间点敲除或表达某个基因,实现对特定基因的时空特异性操作,这对基因功能的研究和人类疾病动物模型的建立都有重大意义。
1.什么是Cre-lox系统?
从名字就能知道这套系统的两个主要组成部分:
Cre重组酶
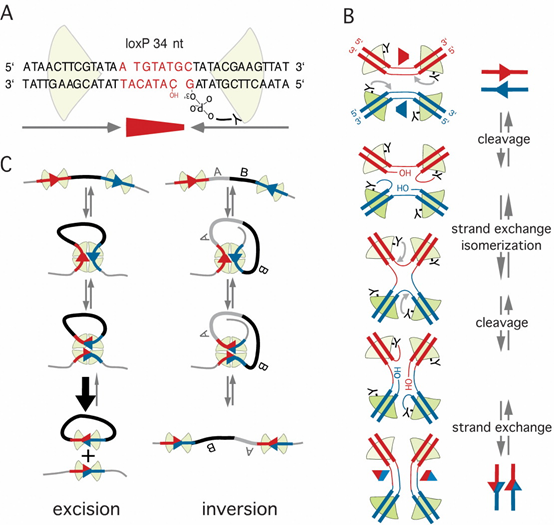
环化重组酶(Cre, cyclization recombinase),是酪氨酸位点特异性重组酶之一,能催化两个DNA识别位点之间的位点特异性重组。Cre重组酶来源于P1噬菌体,由 343个氨基酸组成,能特异性地识别Lox位点。除Cre以外,此类重组酶还有Flp(flipase)和Dre(D6特异性重组酶)。
Lox位点
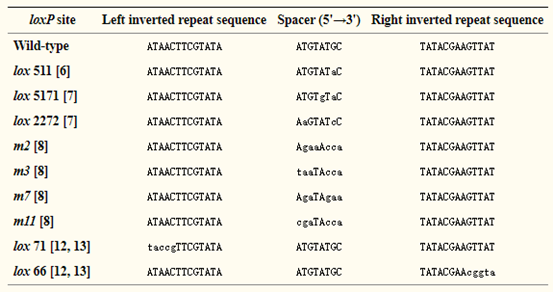
Cre重组酶识别的回文DNA位点,也叫loxP (locus of X-over P1) 位点,长34bp,其特征结构为 ATAACTTCGTATA -NNNTANNN-TATACGAAGTTAT。两边反向互补的13个碱基为Cre重组酶的识别序列,中间的8个碱基为重组发生位置,这也决定了loxP的方向。N表示可变碱基,不同的碱基选择可形成不同的 Lox位点,除了野生型loxP,常见的还有 Lox2272,Lox511,Lox5171等。
在同一个 DNA 分子上,根据Lox位点的位置与方向,可能会发生3种不同的重组事件:
(1)切除:当两个Lox位点在同一染色体上且方向相同时,将切除同向Lox位点之间的DNA序列。
(2)反转:当两个Lox位点位于同一染色体上且方向相反时,两个Lox位点之间的序列发生序列反转,即颠倒。
(3)易位:如果两个Lox位点位于不同的染色体上且方向相同,将导致2条染色体上DNA片段的交换。
2.体内Cre-lox系统的基础应用
Cre-lox系统通常包括两种小鼠:一是Cre工具鼠,该小鼠中的Cre重组酶由特定启动子驱动,可在特定细胞或组织表达Cre重组酶;二是Flox小鼠,即在小鼠靶基因序列两侧带有Lox位点。将上述两种小鼠杂交繁育,子代中可以获得既带有Cre又带有Flox基因的小鼠,即基因条件性敲除或过表达小鼠。
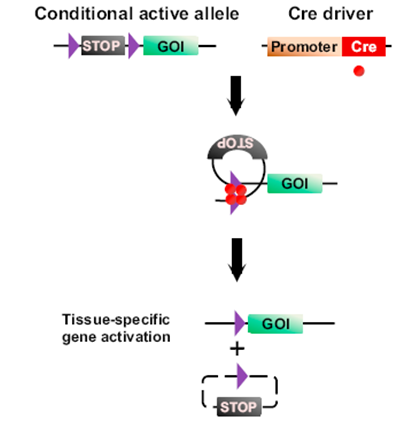
2.1基因条件性表达
基因条件性表达所需要的Flox小鼠,一般在靶基因与启动子之间有一个“终止盒”(lox-stop-lox)。这些Flox小鼠与细胞类型特异性表达Cre的转基因小鼠交配后获得的子代小鼠中,在每个表达Cre重组酶的细胞中,终止盒被Cre切除,因此仅在这些细胞中表达所需的转基因。
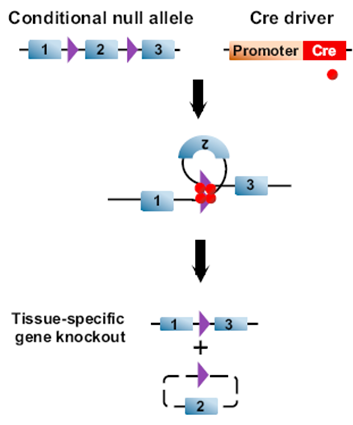
2.2 基因条件性敲除
基因条件性敲除的Flox小鼠,一般在需要切除的DNA片段两侧带有同方向的两个Lox位点(lox-GENE-lox)。与细胞类型特异性Cre小鼠交配后,Cre 重组酶会识别Lox位点,导致靶基因被敲除。
3. 更精准的诱导型Cre-lox系统
为了能够更准确地进行遗传功能研究,时间特异性的Cre-lox(也叫诱导型Cre-lox)被开发出来,可用于研究生物体发育过程特定阶段的基因功能,或用来进行谱系示踪等。常用诱导型Cre-lox系统有:
3.1 CreER系统
也叫他莫昔芬(Tam)诱导的Cre系统,将Cre与雌激素受体ER融合,可通过他莫昔芬(Tam)诱导Cre的重组活性。在没有他莫昔芬的情况下,CreER融合蛋白与热休克蛋白90(HSP90)相互作用并存在于细胞质中(图5.1)。给予他莫昔芬药物处理会破坏HSP90与CreER的相互作用(图5.2)。ER与Tam的相互作用诱导Cre的核易位(图5.3)。在细胞核中,CreER识别loxP位点(图5.4)并使组织X中的基因Y失活(图5.5)。CreERT2在体内对药物诱导的敏感性更高,因此一般优选使用CreERT2。
3.2 Cre;Tet系统
四环素诱导系统,也叫强力霉素(Dox,四环素衍生物)诱导的Cre系统。该系统有两种模式:Tet-on和Tet-off,分别是Dox依赖性Cre的激活和Dox依赖性Cre的失活。Tet系统包括以下元件:反向四环素控制反式激活因子(rtTA);四环素控制反式激活因子(tTA);四环素响应元件(TRE),通常是19个核苷酸的四环素操纵子(tetO)序列的7个重复,调节Cre基因的表达。Dox通常在小鼠的饲料或饮水中进行给药。
Cre;Tet-on系统:在Tet-on系统中,表达普遍存在的或组织特异性的启动子驱动的rtTA。在没有Dox的情况下,失活的rtTA无法与负责调控Cre基因的TRE序列结合,则Cre不表达。在Dox给药之后,Dox结合并激活rtTA。激活的rtTA与TRE序列结合并诱导Cre表达。
Cre;Tet-off系统:另一方面,在Tet-off系统中,在没有Dox的情况下,激活的tTA能够结合Cre前的TRE序列并诱导Cre表达。而在Dox给药后,与Dox相互作用的tTA被灭活。灭活的rTA不再与TRE结合,因此Cre表达受到抑制。
4.南模生物Cre工具鼠库
提供超过300多种自主产权Cre工具鼠,覆盖全身各类型的细胞组织,满足科研人员多样化的需求。同时,我们还在对Cre工具鼠进行全面的验证,目前已经完成了100多种Cre工具鼠的验证工作。
Find Cre整个界面以小鼠组织、器官和系统为主线,可分为肺、肝、胃肠道、乳腺、胰腺、感觉器官、心血管系统、免疫系统、神经系统、泌尿生殖系统、骨骼肌系统以及其他组织器官。
部分Cre品系验证数据如下:
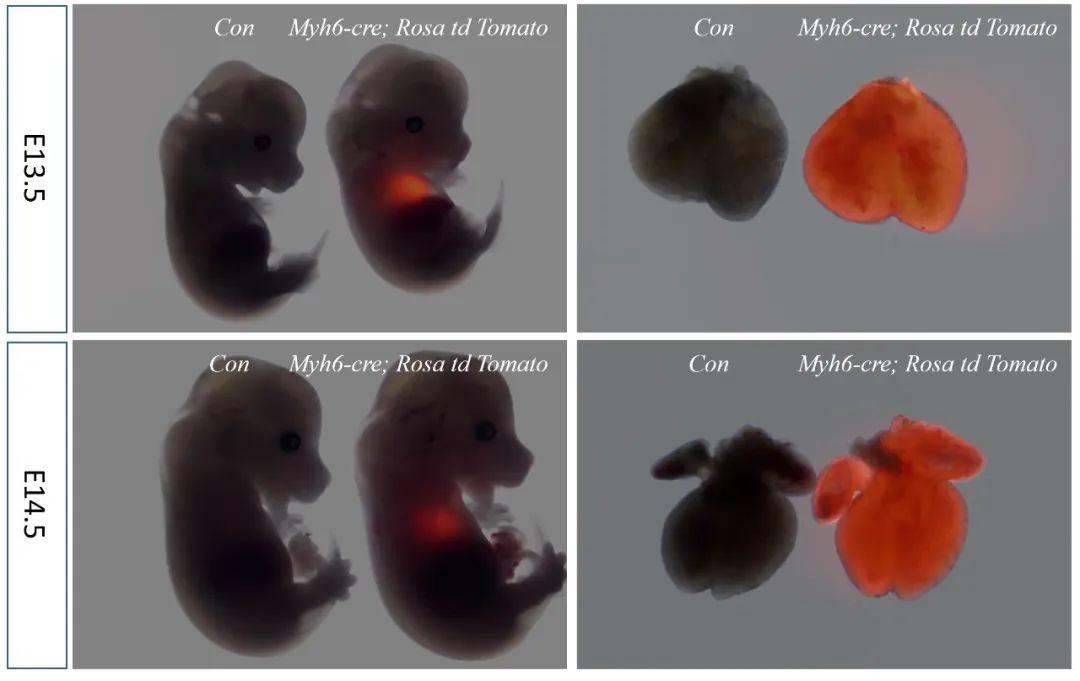
Myh6-Cre
Myh6特异性靶向小鼠心肌细胞,验证数据证明Myh6-Cre鼠是可以用于心脏特异性基因编辑的工具鼠。
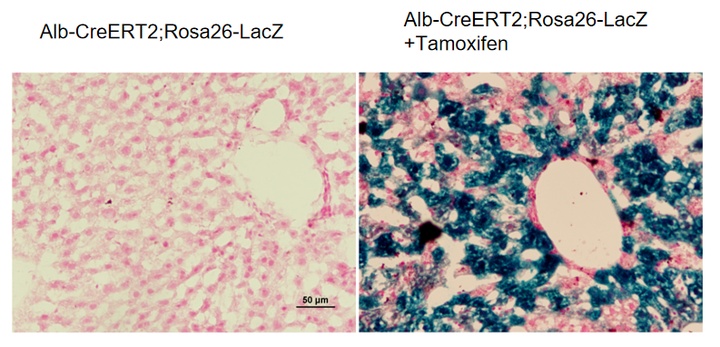
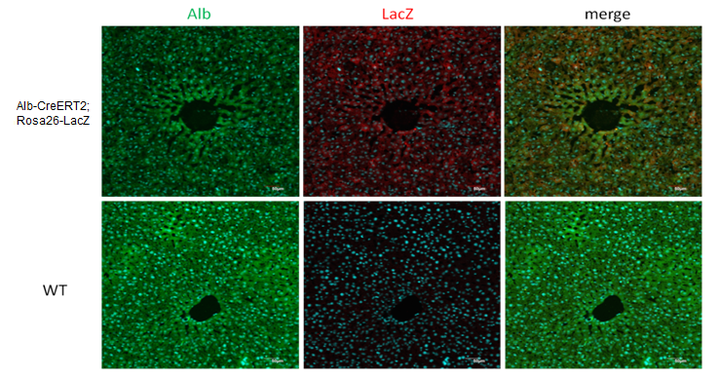
Alb-CreERT2
Alb-CreERT2小鼠是研究肝脏基因功能与疾病的重要小鼠品系,验证数据证明Alb-CreERT2小鼠可以成为实现肝脏时间特异性敲除或表达的工具鼠。
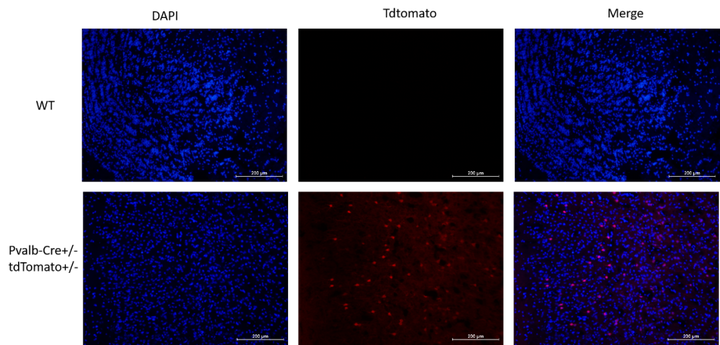
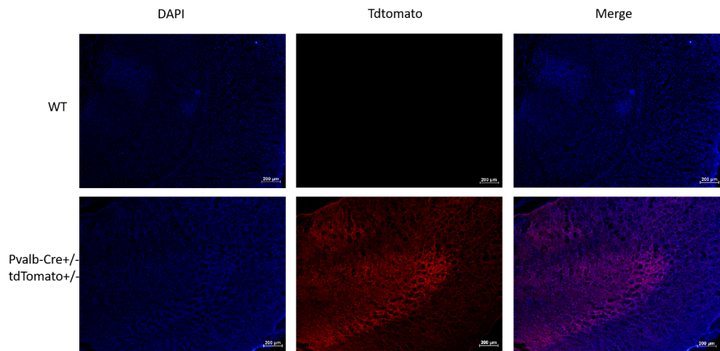
Pvalb-Cre
Pvalb-Cre在中间神经元中表达iCre重组酶,而不干扰内源性Pvalb表达。这些小鼠可能对研究神经元分化有用。
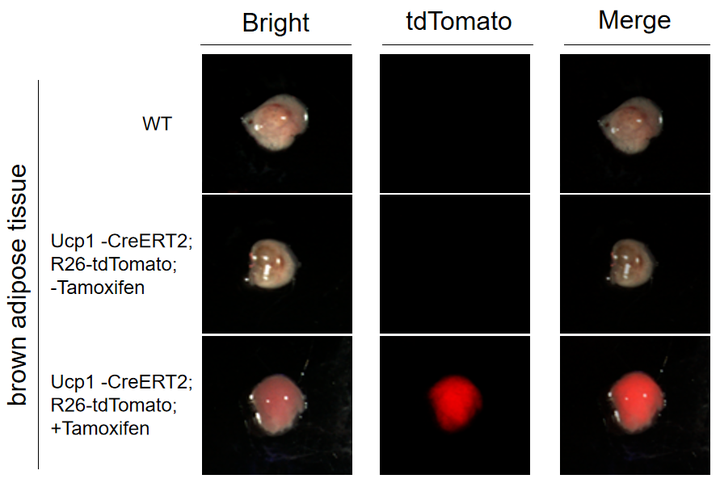
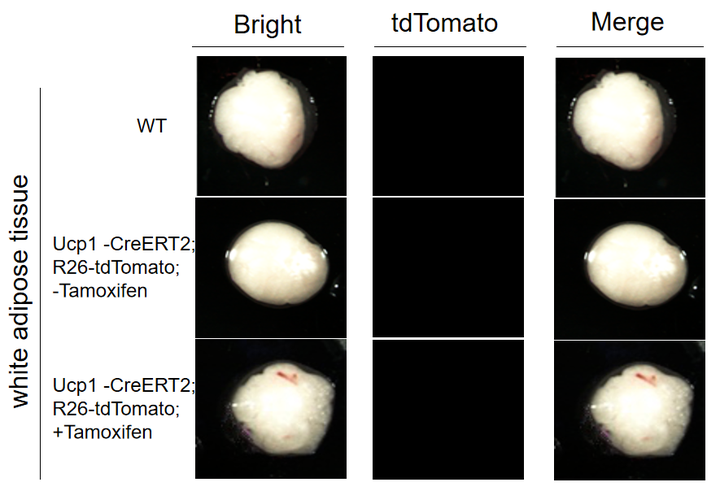
Ucp1-CreERT2
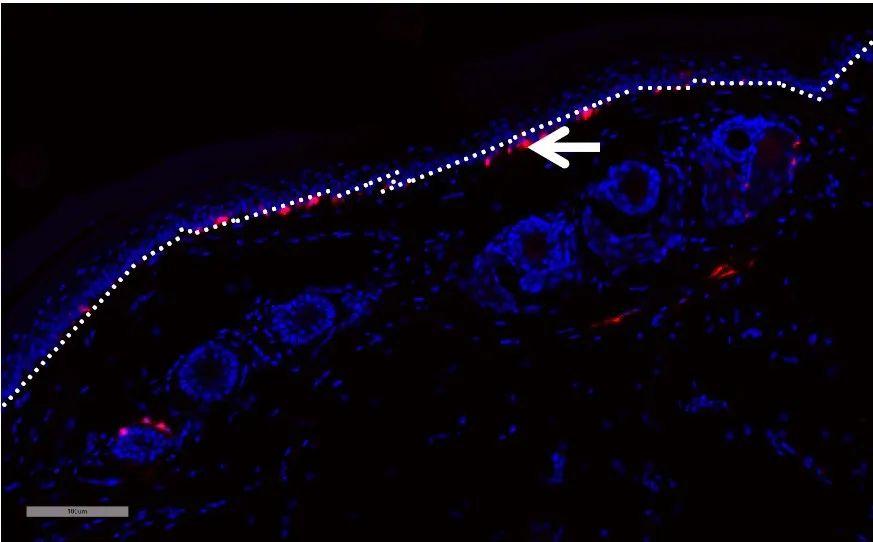
Ucp1-CreERT2在棕色脂肪中表达CreERT2重组酶,验证数据证明Ucp1-CreERT2小鼠是可以用于棕色脂肪特异性基因编辑的工具鼠。
图14. 荧光检测 Ucp1-CreERT2+/- ; R26-tdTomato+/- 小鼠棕色脂肪和白色脂肪中 tdTomato 的表达。Ucp1-CreERT2 小鼠与 R26-tdTomato 小鼠进行交配,取棕色脂肪组织和白色脂肪组织进行荧光显微镜拍照。实验结果显示 Ucp1-CreERT2 小鼠经 Tamoxifen 诱导后可以在棕色脂肪中表达。
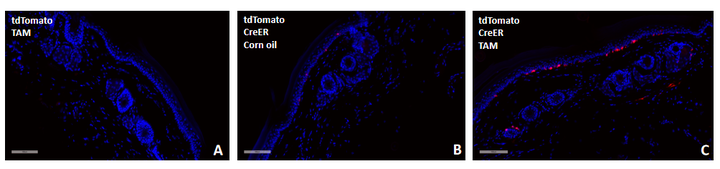
Tyr-CreERT2
Tyr-CreERT2特异性靶向黑色素细胞,验证数据证明Tyr-CreERT2鼠是可以用于黑色素细胞特异性基因编辑的工具鼠。